loading, please wait for a moment...
NOTE: You must enable JavaScript in your browser to view this page.

Chapter 11
羧酸和取代羧酸
Carboxylic Acids and
Substituted Carboxylic Acids



分子中具有羧基(-COOH ,carboxy group)的化合物称为羧酸(carboxylic acids)。羧酸也可看作是烃分子中的氢被羧基取代的衍生物,因此,羧酸通式可写成RCOOH或ArCOOH。
第一部分 羧酸
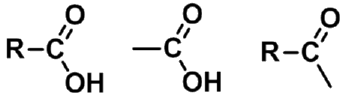
羧酸 羧基 酰基
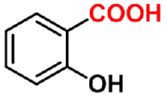
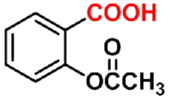
阿斯匹林
aspirin
(解热镇痛药)
水杨酸
salicylic acid



一、分类和命名
- 根据与羧基相连烃基结构的不同分为脂肪酸和芳香酸
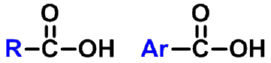
|
|
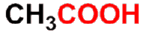

1. 分类


2. 命 名
|
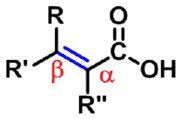
与醛类似,即选择含羧基的最长碳链为主链,从羧基碳原子开始,用阿拉伯数字对主链编号。简单羧酸习惯上也常用希腊字母标位,与羧基直接相连的碳原子位置为α,依次为β、γ、δ……等,最末端碳原子可用ω表示。 |
- 脂肪酸:选择含羧基的最长碳链为主链,从羧基碳原子开始编号(括号中为俗名)
乙酸(醋酸)
acetic acid
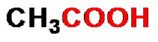
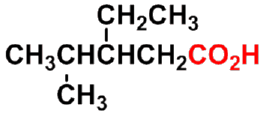
4-甲基-3-乙基戊酸
3-ethyl-4-methylpentanoic acid


- 芳香酸
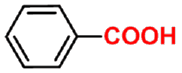
苯甲酸
benzoic acid
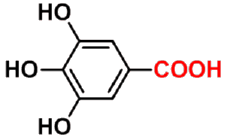
|
3,4,5-三羟基苯甲酸 3,4,5-trihydroxybenzoic acid |
- 不饱和酸:选择含有羧基和重键在内的最长碳链为主链,以酸为母体,碳数跟着重键

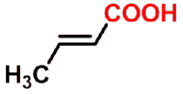
E-2-丁烯酸
E-2-butenoic acid
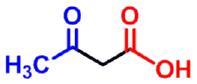
3-氧代丁酸
3-oxobutoic acid



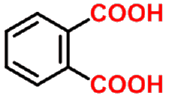
邻苯二甲酸
- 多元羧酸
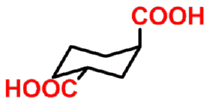
|
(1R,3R)-1,3-环已烷基二羧酸
(1R,3R)-1,3-cyclohexane- dicarboxylic acid |


二、结构及物理性质
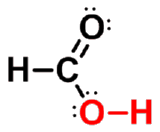
- 结构
|
羧基碳原子为sp2杂化,三个sp2杂化轨道分别与两个氧原子和另一个碳原子或氢原子形成三个σ键。未参与杂化的p轨道与氧上的p轨道形成一个π键,羧基是一平面结构,羟基氧原子上占有未共用电子对的p轨道可与羰基的π键发生p -π共轭, |

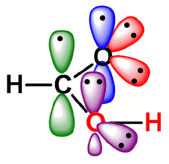

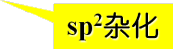


|
|
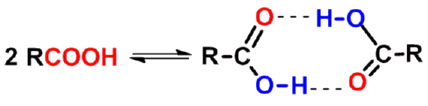
羧酸分子间可以形成氢键。液态可能有二聚(缔合)体存在。羧酸的沸点比分子量相近的醇的沸点高得多。 甲酸沸点(100.5℃)比相同分子量的乙醇沸点(78.3℃)高;乙酸的沸点(118℃)比丙醇的沸点(97.2℃)高。羧酸的沸点通常随分子量增大而升高。 |

|
羧酸与水也能形成很强的氢键,所以丁酸比同数碳原子的丁醇在水中的溶解度要大一些。在饱和一元羧酸中,甲酸至丁酸可与水混溶;其它羧酸随碳链的增长,憎水的烃基愈来愈大,水溶性迅速降低。高级一元羧酸不溶于水,而溶于有机溶剂中。多元酸的水溶性大于同数碳原子的一元羧酸;而芳香羧酸水溶性小。 |



|
三、化学反应 |
(一)酸性和成盐反应
- 几种活泼氢的酸性比较
pKa
~ 5
~ 10
~ 16-19

~ 35
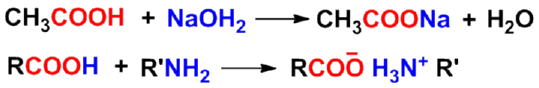
|
羧酸的酸性比酚、醇及其它各类含氢化合物的酸性强。 |


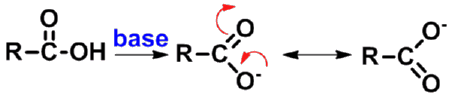
- 羧酸根负离子的稳定性
|
在羧酸根负离子中,有一个π分子轨道,是由一个碳原子和两个氧原子各提供一个p轨道形成的,因此羧基负离子中的负电荷不再集中在一个氧原子上,而是分散于两个氧原子上,使能量降低而趋向稳定。 |
p-π共轭,负电荷分散
两个完全等价的共振式



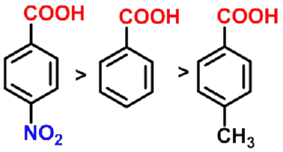
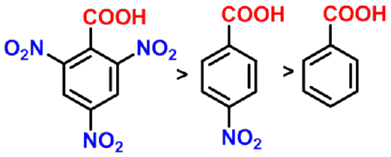
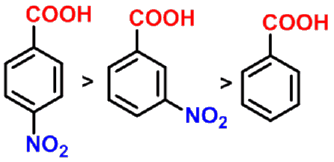
- 吸电子基对羧酸酸性的影响
对脂肪族羧酸,当烷基上的氢原子被卤原子、羟基、硝基等吸电子基取代后,由于这些基团的吸电子诱导效应使羧酸根负离子的负电荷得到分散而稳定性增大,因而酸性增强。
碳链上取代基的吸电子作用越强、数目越多、越靠近羧基,酸性越强。
|
吸电子诱导效应大小次序: |
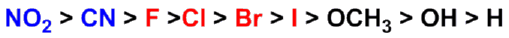
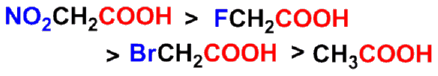



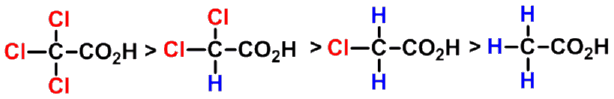
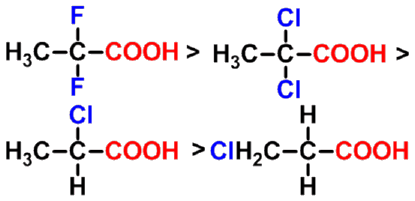



- 供电子基对羧酸酸性的影响

烷基有微弱的给电子诱导效应,同时又有超共轭作用,不利于羧酸根负离子负电荷的分散,稳定性降低,因而酸性降低。
- 羧基的对位或间位有吸电基,酸性比苯甲酸强;对位或间位有供电子基,酸性比苯甲酸弱。





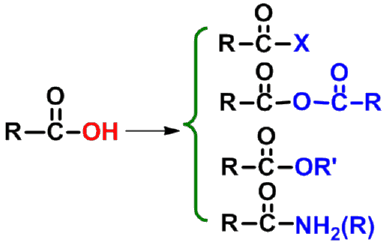
(二)羧基中羟基的取代反应
- 生成羧酸衍生物
酰卤
酸酐
酯
酰胺
|
在一定条件下,羧基中的羟基可以被卤素、酰氧基、烷氧基或氨基取代,形成酰卤、酸酐、酯或酰胺等羧酸衍生物。这些反应都涉及到羧基中羰基的亲核加成与消除。 |


1. 形成酰卤
酰氯
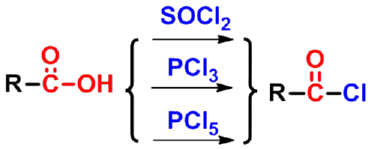

酰溴
|
羧基中的羟基被卤素取代的产物称为酰卤(acyl halide),其中最重要的是酰氯。酰氯是由羧酸与亚硫酰氯、三氯化磷或五氯化磷等氯化剂反应制得。 |


- 同醇的卤代比较学习
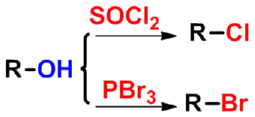
|
酰氯很活泼,容易水解,因此不能用水洗的方法除去反应中的无机物,通常用蒸馏法分离产物。故采用哪种氯化剂,主要决定于原料、产物和副产物之间的沸点差。 |


2. 形成酸酐
简单酸酐
强除水剂
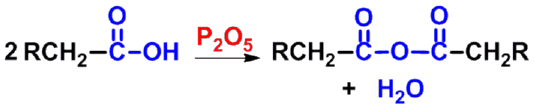
|
羧酸在脱水剂(如乙酰氯、乙酸酐、P2O5等)存在下加热,发生分子间脱水生成酸酐(anhyride)。 |
- 混合酸酐用酰卤和羧酸盐反应
混合酸酐
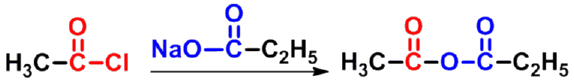


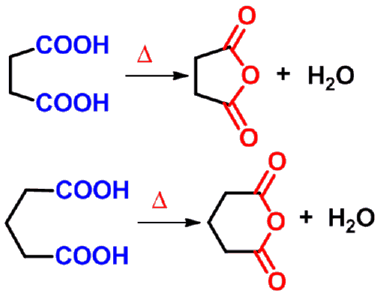
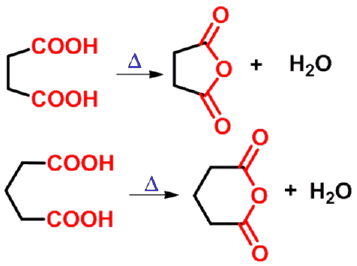
分子内二酸的脱水形成环状酸酐:


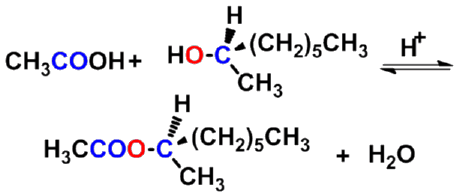
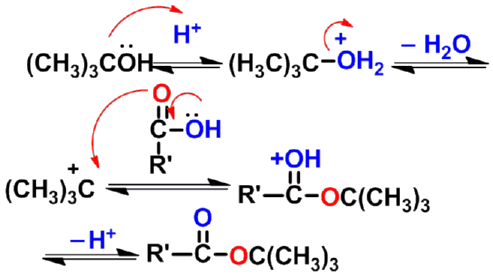
3. 生成酯(酯化反应)

|
羧酸与醇在酸催化下反应生成酯(ester)和水,这个反应称为酯化反应(esterification)。在同样条件下,酯和水也可作用生成羧酸和醇,称酯的水解反应。所以酯化反应是可逆反应。常用的催化剂有硫酸,氯化氢或苯磺酸等。 |

-
酯化反应机理的讨论
-
机理须说明的问题:
-
a. 反应可逆性
-
b. H+ 在反应中起什么的作用?先作用在哪?
- c. 酯中OR‘中氧的来自于酸还是醇?
-
酯化反应特点:
-
反应需要 H+ 催化,无催化剂时反应很慢。
- 反应可逆,称为酯的水解反应(加大反应物用量或除去水使酯的产率提高)



- 两种可能的酯化反应机理
(1)通过酰基上的亲核加成-消除机理(酰氧断裂 )
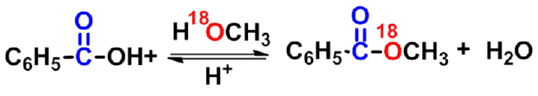


提示:逆过程为酯的酸性水解机理
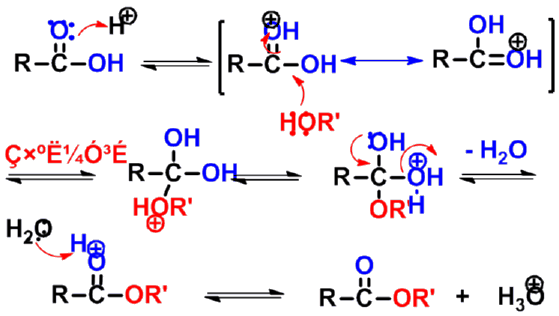



|
不同的醇和羧酸进行酯化反应时的活性顺序为: |
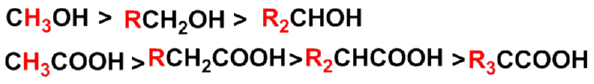
(2) 通过烷基碳正离子中间体(烷氧断裂)
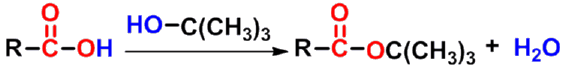


-
H+先与醇羟基氧结合
- 羧基羰基氧作为亲核试剂,OR'上的氧原子来自于酸


4. 生成酰胺
- 提示:一般不用该法合成酰胺
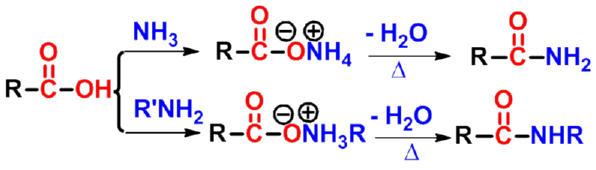
|
羧酸可以与氨(或胺)反应形成酰胺(amide)。羧酸与氨(胺)反应首先形成铵盐,然后加热脱水得到酰胺。 |



㈢ 羧酸的还原反应
- 羧基较难被还原,不能被催化氢化和NaBH4还原;
- 强还原剂(LiAlH4)可还原至伯醇;
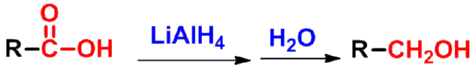
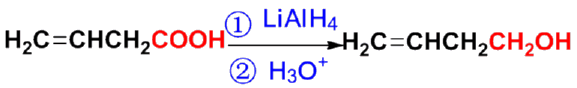


㈣ 羧酸 a 氢的反应
- 比醛酮的a 氢的反应要难
a-卤代羧酸
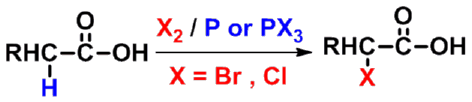


|
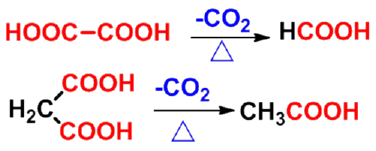
㈤脱羧反应 |
|
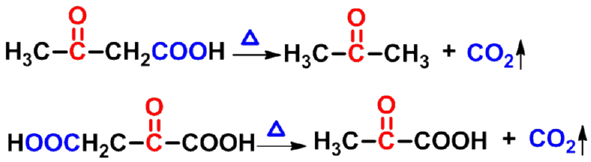


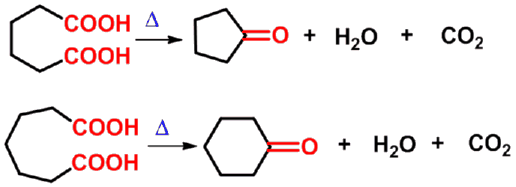
㈥ 分子内二酸的反应
加热即发生脱羧、脱水或既脱羧又脱水反应







|
四、羧酸的制备 |
|
㈠氧化法 |
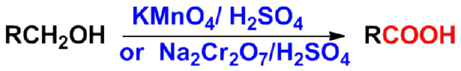
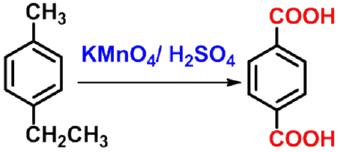
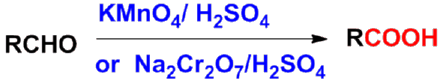

|
制备不饱和酸 |
|
制无α-H的酸 |
|
制备二元酸 |
|
制备少一个碳的一元酸 |
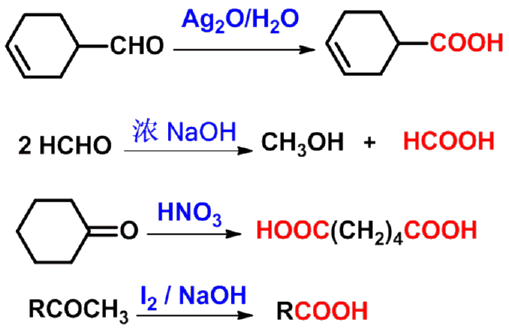




|
㈡ 腈水解法 |
|
应用:制备多一个碳的羧酸。只适用于伯卤代烷,因仲、叔卤代烷在氰化钠(钾)中易发生消除反应。 |
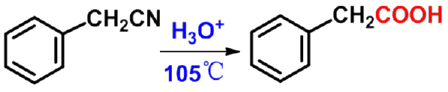
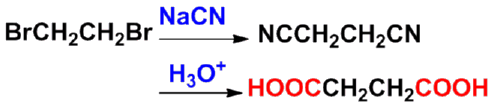
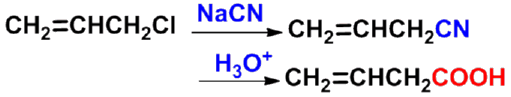



|
㈢格氏试剂法 |
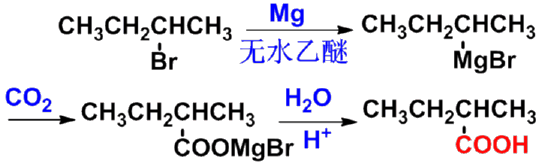
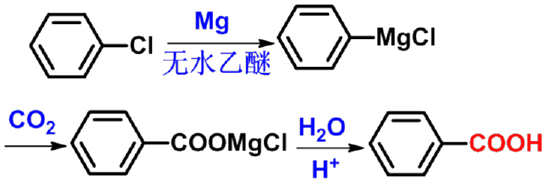

根据烃基上取代基的不同可分为:
卤代酸、羟基酸、氨基酸、羰基酸等
根据取代位置可分为α-、β-、γ-等取代酸
一 分类和命名
- 分类
|
第二部分 取代羧酸 |

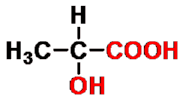
α-羟基丙酸(乳酸)
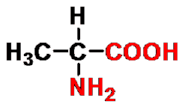
2-氨基丙酸(丙氨酸)
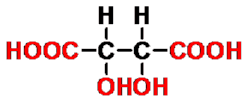
2,3-二羟基丁二酸
(酒石酸)
- 命名(括号中为俗名)

二、卤代酸
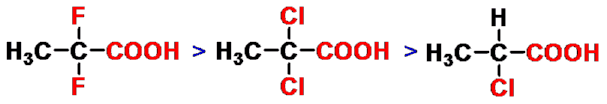
(一)酸性
卤素的吸电子作用越强,数目越多,越靠近羧基,酸性越强

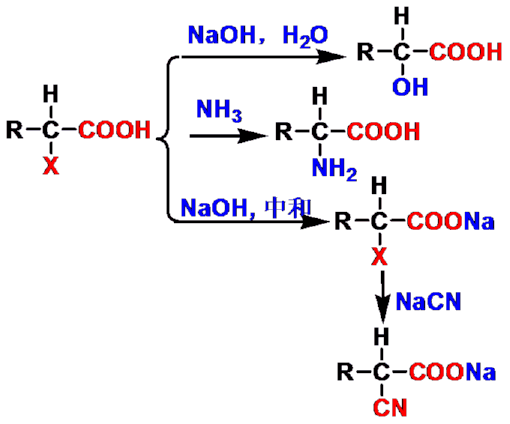
(二)与碱反应
α-卤代酸


β-卤代酸
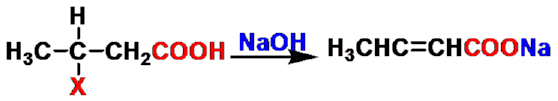
消除反应

反应类型:亲核取代反应
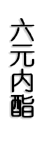
γ,δ-卤代酸
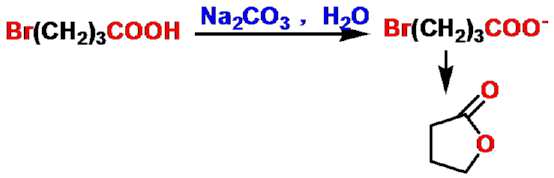
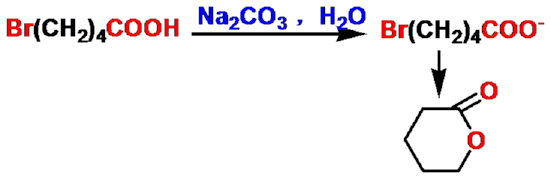

三、羟基酸
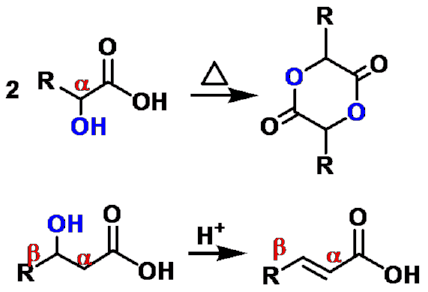
α-羟基酸
β-羟基酸
交酯
α, β-不饱和酸

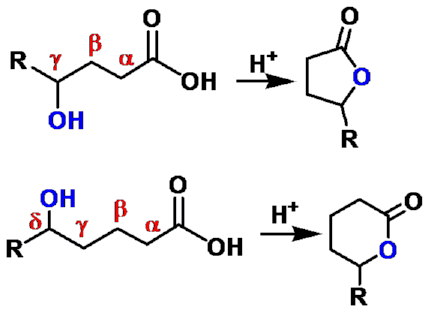
γ-羟基酸
δ-羟基酸
γ-内酯
δ-内酯

- 氨基酸在固态时主要以内盐形式存在
四、 氨基酸
(一) 两性解离和等电点


- 氨基酸的两性离解及等电点
IP (等电点,isoelectric point) :氨基酸处于电中性时的pH值
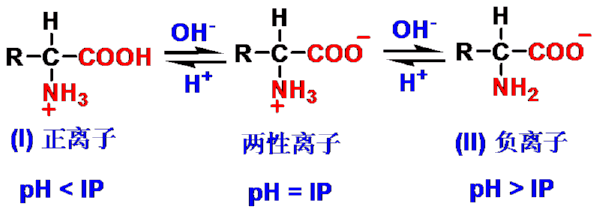

中性氨基酸pI < 7 (5 ~ 6.5)
酸性氨基酸pI ~ 3
碱性氨基酸pI > 7 (7.5 ~ 10.8)
- 等电点时氨基酸以两性离子形式存在,处于电中性状态,在电场中不移动。
- 等电点时氨基酸溶解度最小,易结晶析出

(二) 氨基酸的受热反应
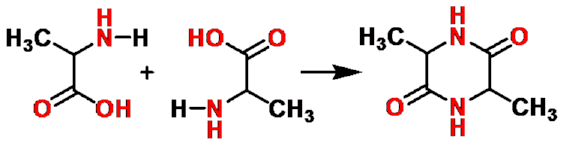
α-氨基酸
交酰胺
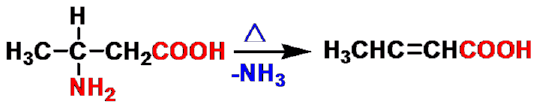
β-氨基酸
α,β-不饱和羧酸

γ,δ-氨基酸
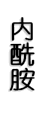
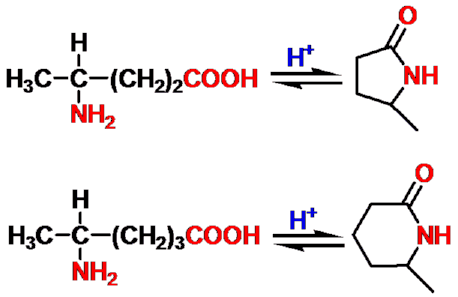

(三) 肽
-
肽:分子量小于10000
- 蛋白质:分子量大于10000




|
五、制备 |
|
Reformatsky反应(瑞褔马斯基反应) |


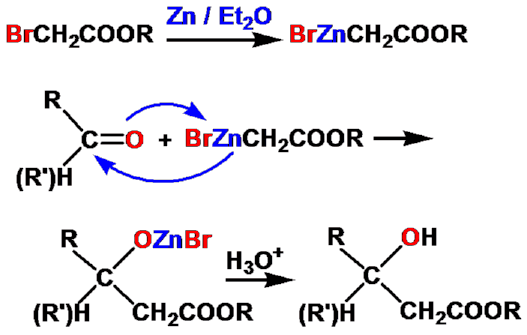
机理:

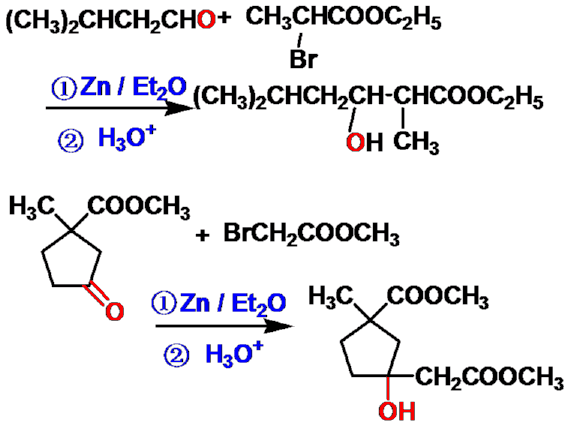
例1:
例2: