loading, please wait for a moment...
NOTE: You must enable JavaScript in your browser to view this page.
1

|
第七章 立体化学 |
|
Chap7 Stereochemistry |
2
If you have not a stereo-concept of organic compounds, you will not learn organic chemistry better.
3

一、同分异构现象
构造式不同
构造式相同
构型不同,不同物质可分离
σ键旋转产生,同一物质不可分离
4
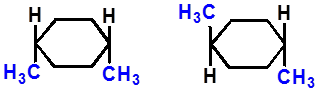
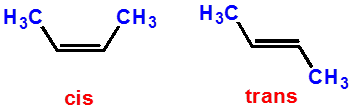
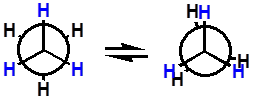
构象异构体
(可互相转化)
构型异构体(顺反异构)
(不能相互转化)
对映异构?
5
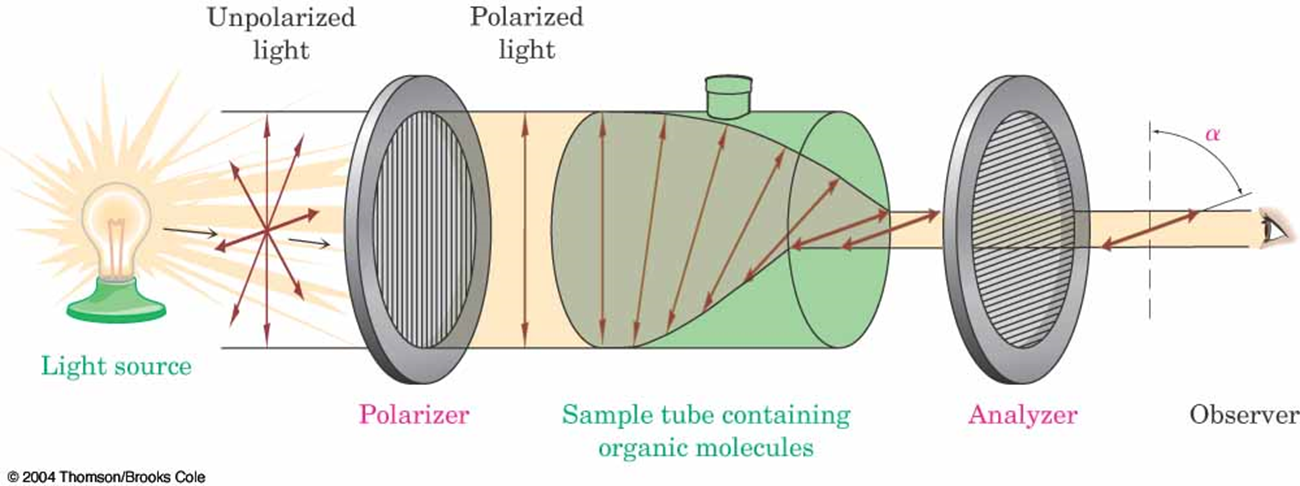
1、平面偏振光(偏振光,偏光)
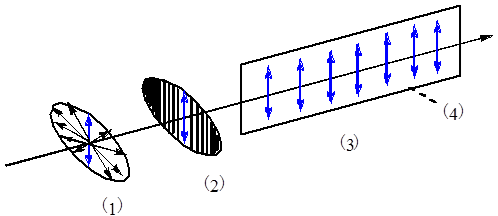
(1)普通光 (2)尼可尔棱镜 (3)平面偏振光 (4)振动面
定义:通过Nicol棱镜后,只在与棱镜晶轴平行的平面上振动的光。
二、几个基本概念
6
肌肉运动
乳糖发酵
酸牛乳
乳酸
乳酸
乳酸




偏振光
右旋
左旋
无影响
不同物质对偏振光的影响不同
7
2、旋光性物质
使偏振光振动面右旋(顺时针)的物质称右旋体,
用d 或(+)表示
使偏振光振动面左旋(逆时针)的物质称左旋体,
用l 或(-)表示
旋光性物质:能使偏振光振动面旋转的物质,也称光活性物质。
外消旋体:等量的右旋体和左旋体的混合物,用dl 或(±)表示
8

α:旋光度;t:温度;λ:光波长;c:样品浓度,单位g/ml; l: 样品管长度,单位dm。
|
在一定条件下,比旋光度是一个常数。 |
|
葡萄糖: |
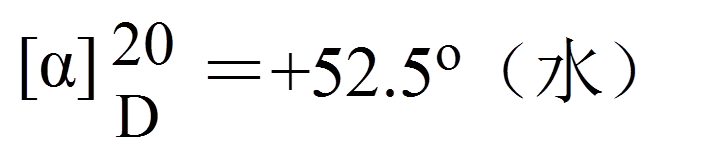
旋光度(α): 偏振光振动面旋转的角度。
与分子的结构及数量有关,不唯一。
9
4、手性chirality :实物与镜像不能重叠

5、手性分子:与其镜像不能重叠的分子
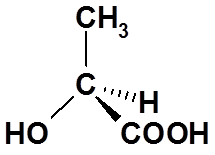
C
C
H
3

O
H

H




H
O
O
C


*
*
10
|
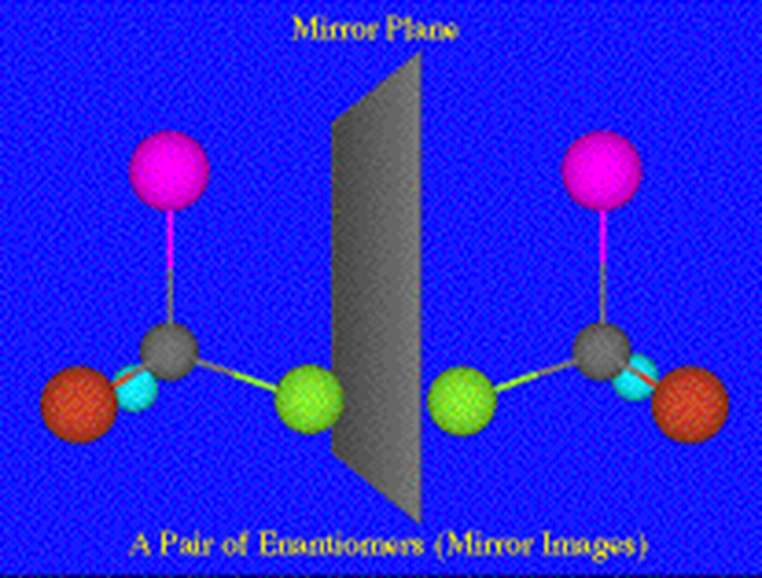
6、对映异构体 |
|
具有实物和镜像的关系,结构相似,但不能重叠的两种分子。 |
手性分子有对映异构体,有旋光性
非手性分子没有对映异构体,无旋光性
11
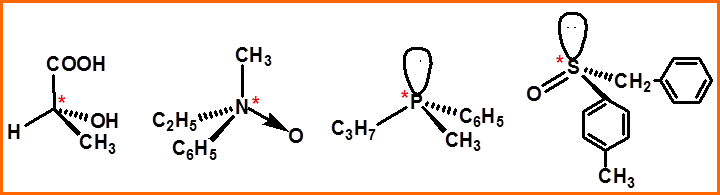
7、手性碳(Chiral carbon, 不对称碳原子)
连有四个不同原子和基团的碳原子,以C*表示
此外还有手性氮、磷、硫原子
|
注:手性原子不是分子产生手性的绝对条件 产生手性的必要和充分条件是分子与其镜像不能重叠 |
12
三 分子的对称性与手性
分子与其镜象是否能互相叠合决定于分子本身的对称性。即分子的手性与分子的对称性有关。
对称元素: 对称面、对称中心。
1、对称面(σ)
定义: 若有一个平面,能将分子切成两部分,一部分正好是另一部分的镜象,这个平面就是这个分子的对称面。
13

有两个对称面
无手性

C
H
H
Cl

C

Cl
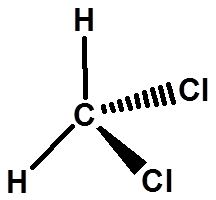
实物和镜像重叠,无手性
分子中有一个对称面









C
H
3

H

C
H
3

H

























C
H
3

H

C
H
3

H

14
|
2、对称中心 通过对称中心的直线,在距离中心等距离处可以遇到完全相同的原子或基团。 |
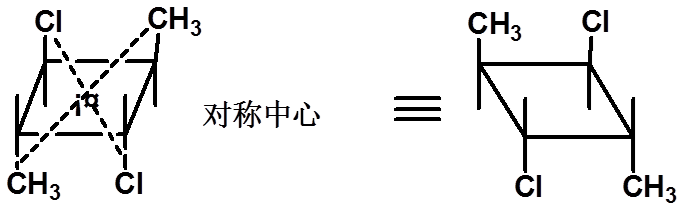
无手性
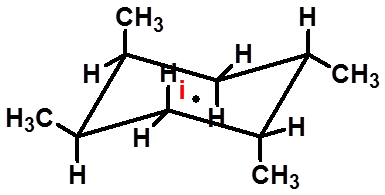
15

|
判断分子是否具有手性主要看分子中是否存在对称面或对称中心。 如果分子存在对称面或对称中心则该分子为非手性分子,没有旋光性。反之,没有对称面,也没有对称中心则为手性分子,有旋光性,有对映异构体。 |
总结:
16
|
Ex:下面化合物哪些具有对映异构体? 并画出对映体的结构: |
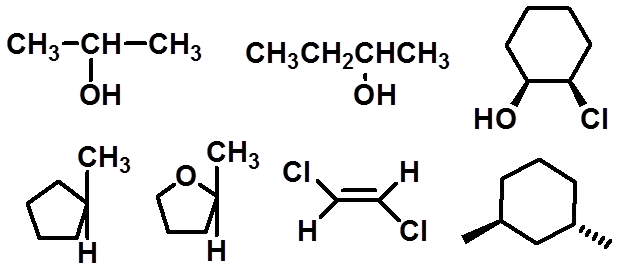
17
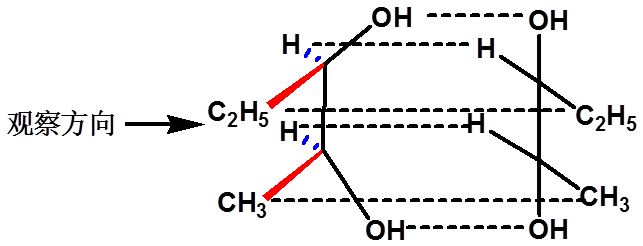
(Fischer projection)
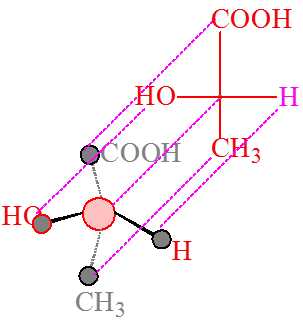
竖向2个原子或基团朝后,横向2个原子或基团朝前,交点处代表手性碳原子。
“横前竖后”
|
四、对映异构体的表示方法---费竭尔投影式 |

观察方向
|
含有一个手性碳: |
18
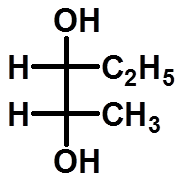
|
含有两个手性碳: |
19
注:同一分子可画出多个不同费竭尔投影式
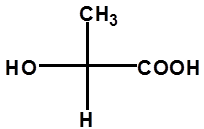
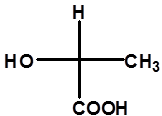
一般将碳链放在竖直方向,氧化态高的基团放上端(-COOH>-CHO>-CH2OH>-CH3)。
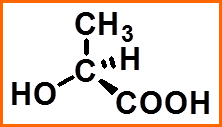
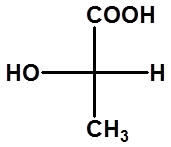
(1)
(1)
(2)
(2)

(3)
(3)


20
(1)投影式不能离开纸面翻转,如投影式在纸平面旋转180º或其整数倍,则构型不变,若旋转90º或其奇数倍,则转变为其对映异构体。
|
费歇尔投影式转换时的基本规则: |
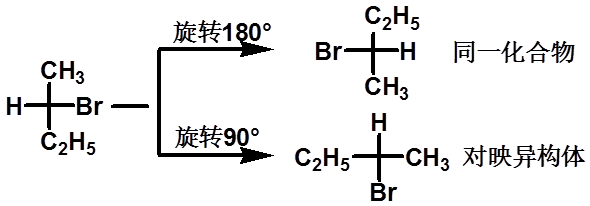
21
(2)若将手性碳原子上任何两个原子或基团相互交换奇数次,构型转化;交换偶数次构型保持。
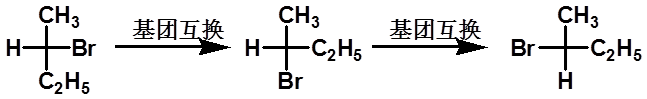
|
(a) (b) (c) |
|
(a)和(c)是同一种化合物, (a)或(c)与(b)互为对映异构体。 |
22
(3)若固定投影式的一个基团不动,其余三个基团按顺时针或逆时针方向旋转,构型保持不变。
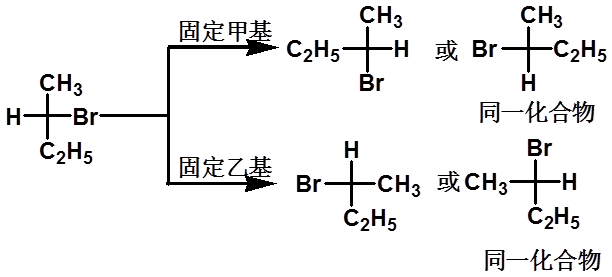
23
|
费歇尔投影式与各种结构式间的互换 |
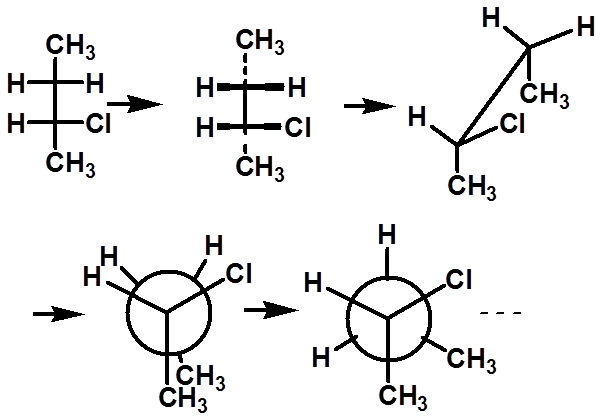
重叠式
注:费歇尔投影式转变成锯架式时均为重叠式
24

|
五、对映异构体构型的标记 |
首先按照次序规则确定手性碳原子上所连四个原子或基团的优先次序,假定为a>b>c>d , 接着从最小原子或基团的对面观察其它三个原子或基团由大到小的排列顺序,顺时针排列的为R型,逆时针排列的为S型。
1、 R、S标记法
25
|
Specification of Configuration |
构型的标记
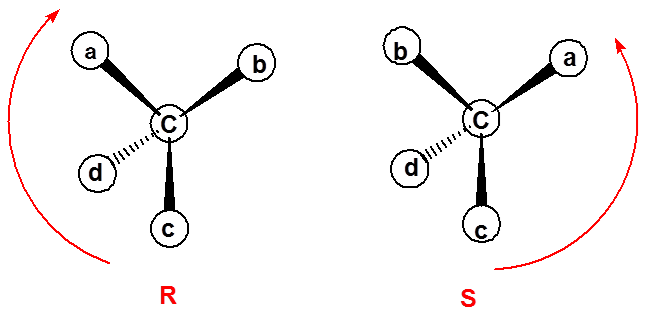
26
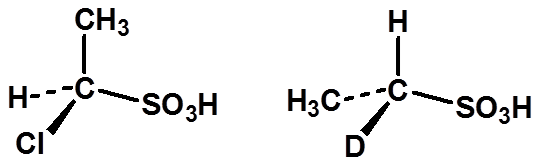
|
次序规则(同烯烃) |
R
S
R
R
a
b
c
d
a
b
c
d
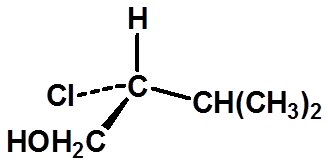
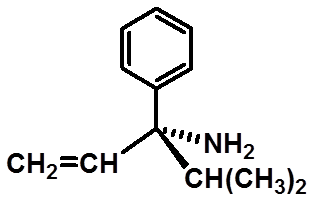
a
b
c
d
a
b
c
d
27
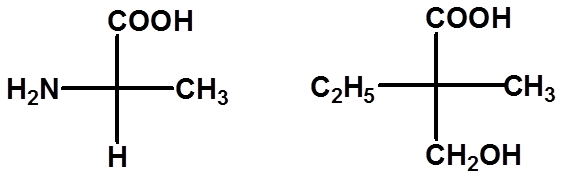
|
对费歇尔投影式的构型的标记 |
|
(1) 当次序最低的原子或基团位于垂直方向上, 顺--R,逆--S |
|
(2) 当次序最低的原子或基团位于水平方向上,顺-S,逆-R |
R
S
a
b
c
a
b
c
28
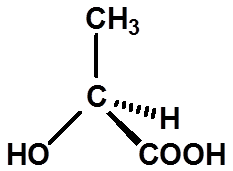
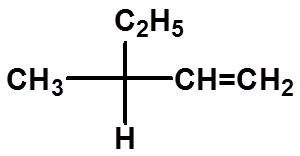
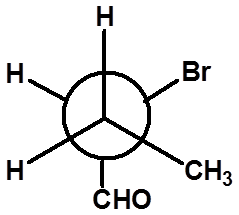
Ex:判断手性碳的构型:
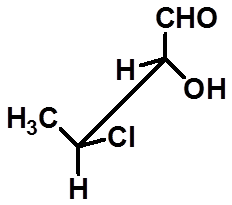
29
|
多种投影式如何判断是否是同一种物质?
法一:定R、S
法二:基团交换法(同一手性碳上) 经偶数次交换构型不变,经奇数次交换构型改变 |
R
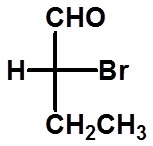
=
定R、S
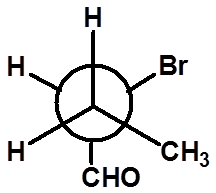
30
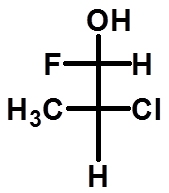
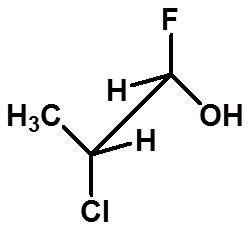
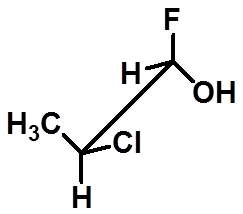
≠
≠
S
S
S
R
定R、S
基团交换
判断是否是同一种物质:
31
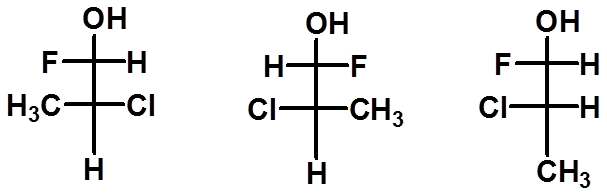
Ex:判断下列Fischer式是否是同一种物质:
1
2
3
32
|
2. D、L命名法(了解) |
|
Fischer以甘油醛为标准来确定对映体的相对构型 |
|
D-(+)-甘油醛 D-(-)-甘油酸 D-(-)-3-溴-2-羟基丙酸 D-(-)-乳酸 |
|
D. L法有一定的局限性,仅在糖类和氨基酸中应用 |
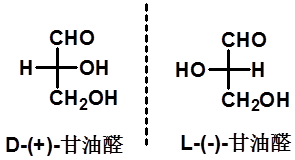
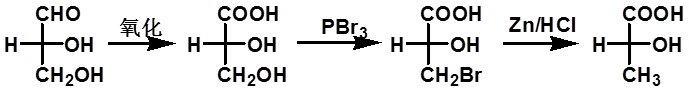
33
|
六、含一个手性碳原子化合物的对映异构 |
含一个手性碳的分子一定是手性分子,有一对对映体。
|
(R)-(+)-乳酸 (S)-(-)-乳酸 |
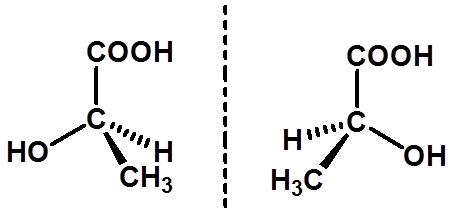
|
等量的一对对映体组成的混合物称外消旋体 注:R≠右旋,S≠左旋 |
34
|
1、对映异构体的性质 |
在非手性环境下除旋光性以外,其它性质基本相同,不能用简单物理方法进行分离。
旋光性:方向相反,绝对值相同(或接近)
|
熔点/℃ pKa25º 比旋光度(水) |
|
(+)-乳酸 53 3.79 +3.82°
(-)-乳酸 53 3.79 -3.82°
(±)-乳酸 18 3.79 0°
|



35
2、手性环境下反应速度不同,生理活性差别大
(R)型,有效,不致畸形
(S)型,致畸形
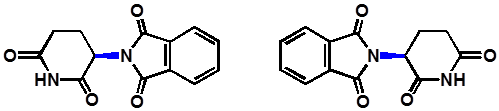
Thalidomide(反应停)
*
*
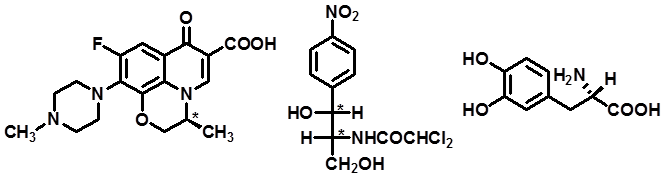
|
左氧氟沙星 D-(-)-氯霉素 左旋多巴 |
36
|
3、获得单一光学异构体的方法(了解) |



|
诺尔斯 |
|
野依良治 |
|
夏普莱斯 |
|
因不对称催化合成获2001 诺贝尔奖 |
37
对映异构体过量百分率
对映异构体过量百分率和光学纯度(了解)
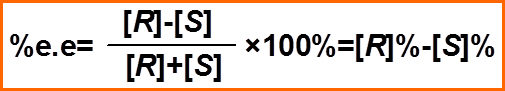
|
光学纯度百分率 |
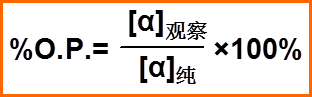
|
[R]为主要对映体的量,[S]为次要对映体的量 |
|
[α]观察为测得的混合物的旋光度, [α]纯为测得的纯的异构体在相同条件下的旋光度 |
38
|
七、含2个手性碳原子化合物的对映异构 |
(一) 含2个不相同手性碳原子的化合物
(手性碳所连基团不完全相同)
丁醛糖
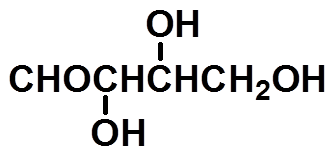
*
*
异构体数目: RR、SS、RS、SR
n个手性碳,2n 个异构体
39


*
*
|
D-(-)-赤藓糖 L-(+)-赤藓糖 L-(+)-苏阿糖 D-(-)-苏阿糖 |
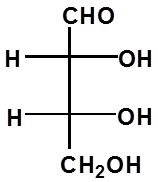
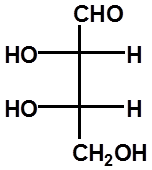
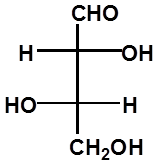
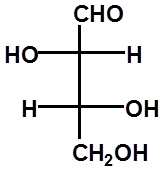
RR SS RS SR
A B C D
A与B、C与D为对映体
A与C、D;B与C、D为非对映体
40
非对映体(diastereomers):构造相同,不为镜像,不能重叠的异构体。
特点:旋光度不同,其它物理性质也不同。

赤型或赤式(Erythro-)
苏型或苏式(Threo-)
赤:两个相同的原子或基团在费歇尔投影式的同侧
苏:两个相同的原子或基团在费歇尔投影式的异侧
|
赤型和苏型 |
41
(二)含两个相同手性碳原子的化合物
两个手性碳原子上连有同样的四个不同基团
酒石酸
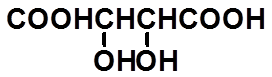
*
*
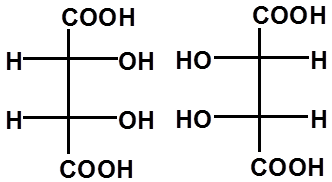
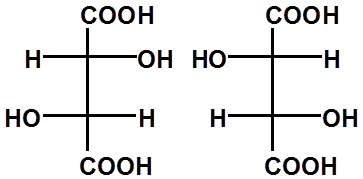

RR SS RS SR
同一物质
(内消旋体)

≡
一对对映体
42
内消旋体(meso):分子中有手性碳,但由于对称整个分子失去手性。
(一个手性碳的旋光性正好被分子内另一构型相反的手性碳所抵消)
几种酒石酸的理化性质:
|
酒石酸 |
mp(℃) |
溶解度(20℃) [g·(100 mL H2O)-1] |
密度(20℃) (g·cm-3) |
pKa1 |
pKa2 |
|
|
(+)
(-)
meso (±) |
170
170
140 206 |
+12
-12
0 0 |
147.0
147.0
125.0 20.6 |
1.760
1.760
1.666 1.687 |
2.93
2.93
3.20 2.96 |
4.23
4.23
4.68 4.24 |
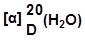
|
内消旋体:无旋光。原因:分子内部手性C原子旋光能力相互抵消 外消旋体:无旋光。原因:两种分子间旋光能力抵消 |
43
|
(三)含有三个手性碳的化合物(了解) |
|
如手性碳都不同,则有四对(23 个)对映异构体 |
|
有两个手性碳是相同: |
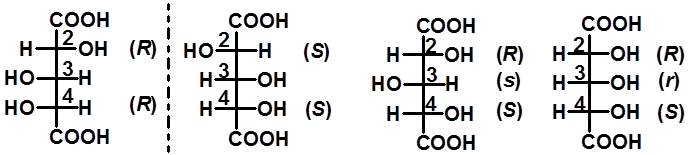
|
C3非手性 |
|
C3假手性碳 |
|
对映体 内消旋体 内消旋体 |
44
|
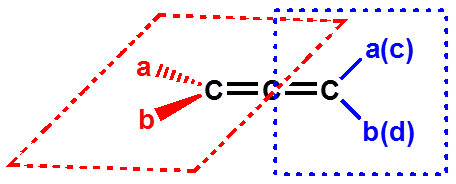
八、含手性轴化合物的旋光异构体 |
|
(一) 丙二烯型化合物的旋光异构体 |
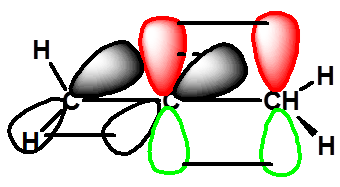
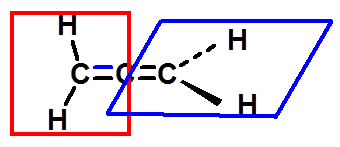
结构
45
|
两个Cab处于互相垂直的平面上,使分子没有对称中心和对称面。两个Cab围绕C—C—C键轴的排列是不对称的,称其为手性轴。 |
a≠b,c≠d
有手性
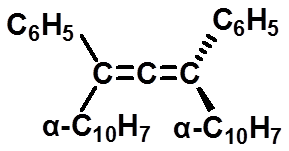
|
第一个合成的具有光活性的丙二烯型化合物 |
46
|
右旋 |
|
左旋 |

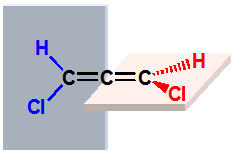
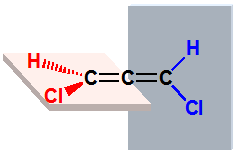
一对对映体
47
环烯型:环上及双键碳有不同的取代基时有手性
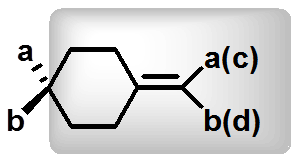
a≠b,c≠d
有手性







C


H
C
O
O
H
C
H
3


H







C


H
H
O
O
C
C
H
3


H
















一对对映体
48

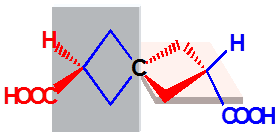
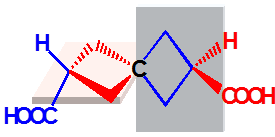
螺环型
a≠b,c≠d
有手性
一对对映体
49
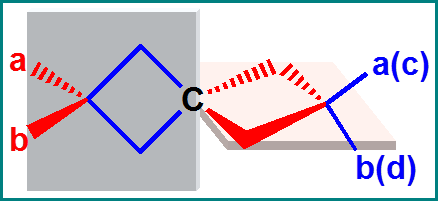
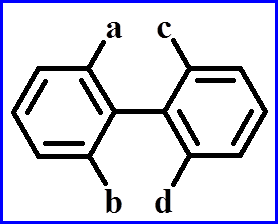
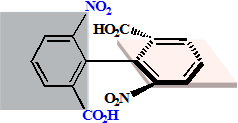
联苯型(阻转异构)




最稳构象
不稳构象
a≠b, c≠d,
且基团体积足够大
时有手性
50
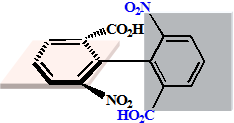

连接两苯环的σ键称为分子的手性轴
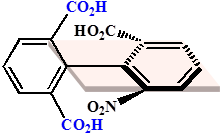
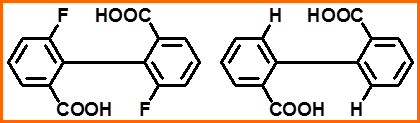
|
可拆分 迅速外消旋化 |
非手性
不可拆分
51
综上
52
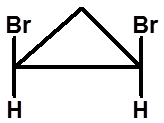
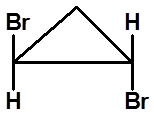
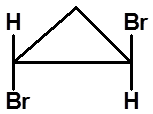


S
R
S
S
R
R
(1S,2S)-1,2-二溴环丙烷
(1R,2R)-1,2-二溴环丙烷
|
顺-1,2-二溴环丙烷
有对称面,无手性 内消旋体 |
|
反-1,2-二溴环丙烷 无对称因素,有手性 |
九、取代环烷烃的立体异构
|
顺反:指的两个C上基团相对位置 对映:指的是一个C*上的相对位置 |
环状分子顺反异构和对映异构往往同时存在
53
|
注:考虑环烷烃的立体异构体时
先看有无顺反,再看有无对映异体
若环分子中不存在对称因素,则分子具有手性, 则有对映异构体,命名时不能用顺反,应用R,S构型区分 |
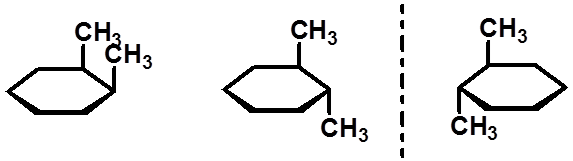
|
顺-1,2-二甲基环己烷 |
|
(1R,2R)-1,2-二甲基环己烷 |
|
(1S,2S)-1,2-二甲基环己烷 |
54
十、多取代环己烷的构象
|
保持构型不变:顺反,手性C*的构型
构型式和构象式中碳环编号顺序一致 构型式和构象式中基团上下关系一致 |
例如:画出以下二取代环己烷的优势构象

55
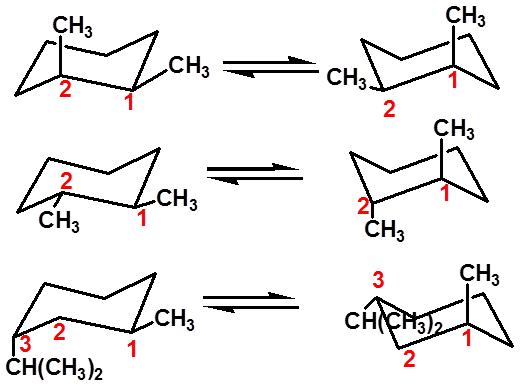
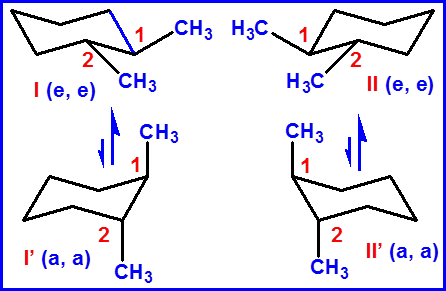
优势构象(ee)
能量相同
优势构象
大基团位于e键稳定
|
aa |
|
ea |
56
优势构象
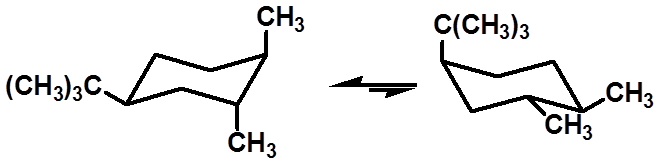
|
(1R,2R,4S)-1,2-二甲基-4-叔丁基环己烷的优势构象 |
叔丁基总是处于e键上,称为构象控制基团
|
(conformation control group) |
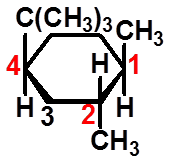
57
总结取代环己烷优势构象总原则:
①椅式构象一般为稳定构象
②在多取代环己烷中,一般取代基占横键多
的为优势构象
③含不同取代基时,体积较大的处于横键为
优势构象
④具有大体积的基团如叔丁基,则它处于横
键的构象为优势构象
|
Ex:画出(1S,3S)-1-甲基-3-氯环己烷优势构象 |
58
|
例外: |
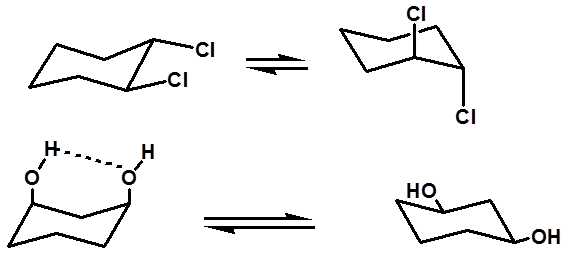
|
aa构象(优势构象) |
|
aa构象(优势构象) |
59
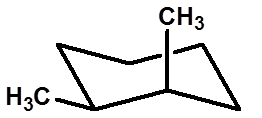
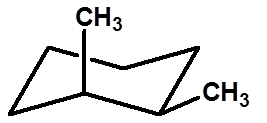


R
S
S
R
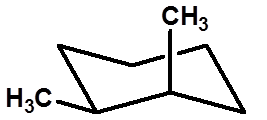
S
R
|
十一、取代环己烷的椅式构象的手性现象 |
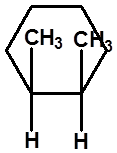
|
无旋光性 |
|
相同,无旋光性 |

顺-1,2-二甲基环己烷
60
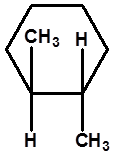
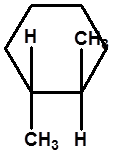

研究环己烷的构型,可将环己烷作为一个平面结构来考虑
反-1,2-二甲基环己烷
|
有旋光性 |

|
有旋光性 |
2
1
1
2
61
|
十二、十氢萘的构象 |

|
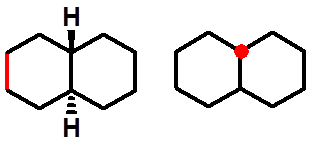
顺式十氢萘 |
|
反式十氢萘 |
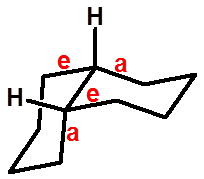
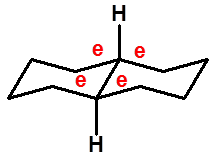
|
ee(反式)稠和,不能翻转, 有对称中心,非手性分子 |
|
ea(顺式)稠和,手性分子 可翻转,无旋光 |
稳定构象
62
一取代有几种产物?
几种馏分?
是否有旋光性?
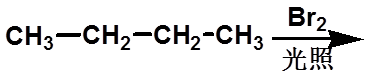
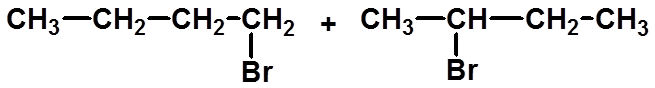
*
十三、旋光异构在研究反应机理中的应用
|
(一)、自由基卤代反应 |
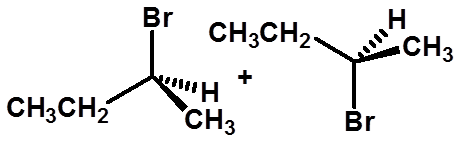

1、非手性分子的反应
有3种产物,2种馏分,无旋光性
63

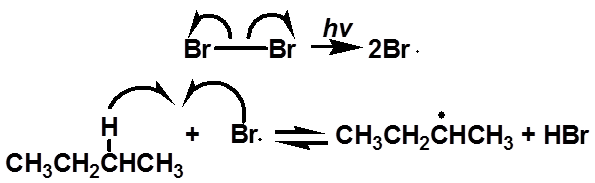
等量的一对对映体
无旋光性
无旋光性的反应物生成无旋光性的产物

前手性碳
64
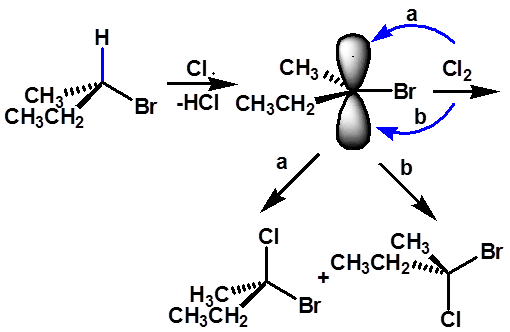
2、手性碳原子的反应
|
有旋光性的反应物生成外消旋体,无旋光性 |
产物外消旋化
|
例如:(S) -2-溴丁烷在C2上氯代 |
65
|
3、(S)-2-溴丁烷C3的氯代反应 |
|
2S 2R,3S 2S,3S 75% 25% |
|
不等量的一对非对映异构体
(立体选择性反应) why? |
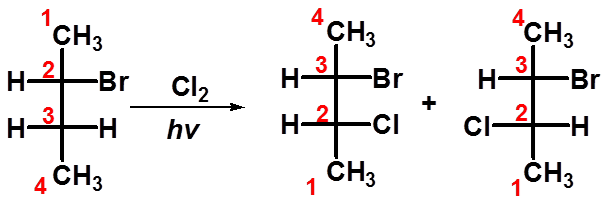
66
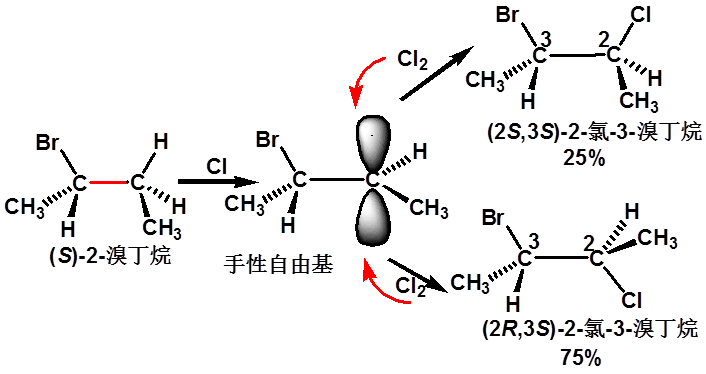
溴影响,位阻大
位阻小
67
|
(二)、卤素与烯烃的加成反应 |
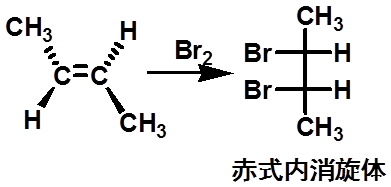
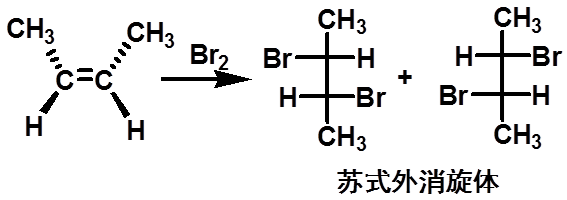
68
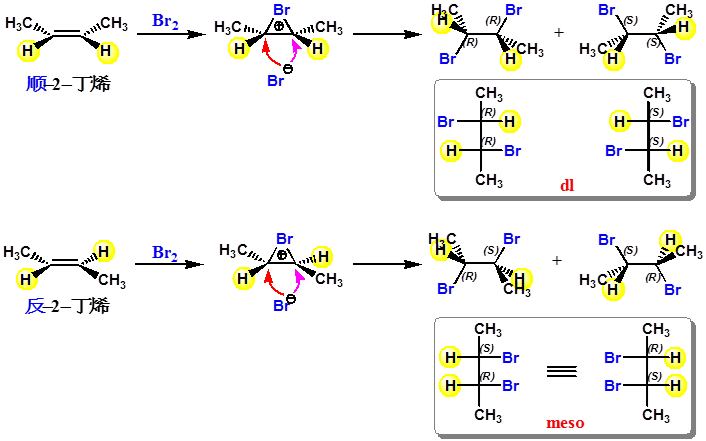
立体化学不同的反应物生成立体化学不同的产物,称立体专一性反应
69
楔形式与Fischer式的转换
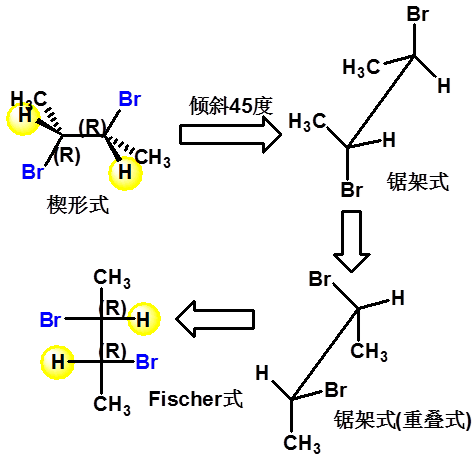
70
立体化学解释了该反应为溴鎓离子机理的正确性
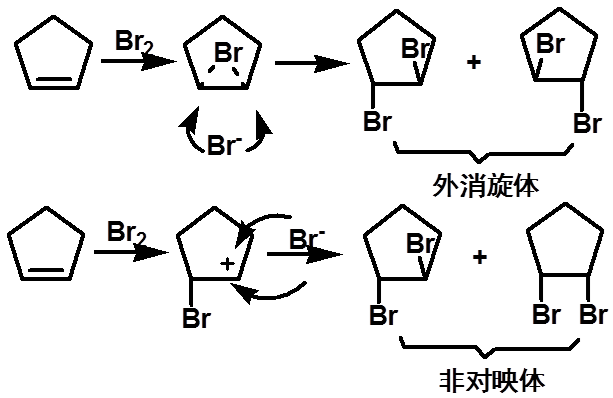
71
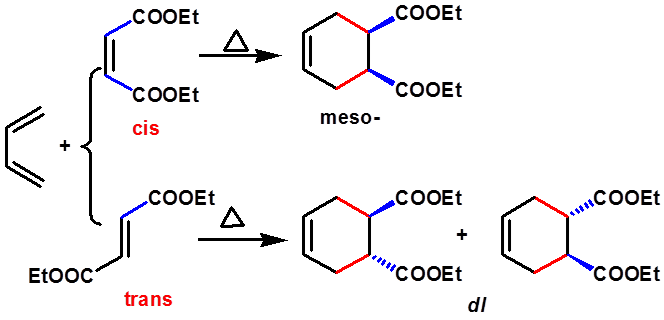
Diels-Alder反应的立体专一性:
亲二烯体的顺反关系保持不变
72
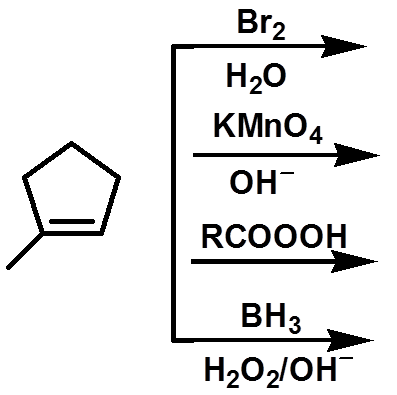
Ex:
|
loading, please wait for a moment... NOTE: You must enable JavaScript in your browser to view this page.
LogsX
|